Статьи/ Богатое семейство углеродных материалов
Богатое семейство углеродных материалов
Ни один элемент Периодической системы Менделеева не обладает тем разнообразием свойств, иногда прямо противоположных,
которое присуще углероду. Столь уникальные свойства - причина того, что и чистый углерод, и содержащие его материалы служат
объектами фундаментальных исследований и применяются в бесчисленных технических процессах. Все это ярко свидетельствует о его
огромной важности для цивилизации.
Страницы: 1 |
2 |
3 |
4 |
5 |
6 |
Основные модификации углерода
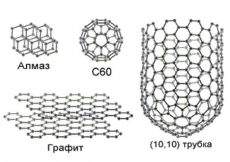 Углерод известен человечеcтву с древнейших времен, прежде всего как уголь и алмаз. Как индивидуальный химический элемент углерод
был признан Лавуазье в конце XVIII в. и получил свое название (Carboneum) от латинского carbo - уголь. Ни один элемент Периодической
системы Менделеева не обладает тем разнообразием свойств, иногда прямо противоположных, которое присуще углероду. Столь уникальные
свойства - причина того, что и чистый углерод, и содержащие его материалы служат объектами фундаментальных исследований и применяются
в бесчисленных технических процессах. Все это ярко свидетельствует о его огромной важности для цивилизации. Еще несколько десятилетий
назад были известны три основных аллотропных формы углерода: алмаз, графит и карбин. Однако в последнее время были открыты новые
модификации углерода, обладающие уникальными свойствами – фуллерены и углеродные нанотрубки.
Углерод известен человечеcтву с древнейших времен, прежде всего как уголь и алмаз. Как индивидуальный химический элемент углерод
был признан Лавуазье в конце XVIII в. и получил свое название (Carboneum) от латинского carbo - уголь. Ни один элемент Периодической
системы Менделеева не обладает тем разнообразием свойств, иногда прямо противоположных, которое присуще углероду. Столь уникальные
свойства - причина того, что и чистый углерод, и содержащие его материалы служат объектами фундаментальных исследований и применяются
в бесчисленных технических процессах. Все это ярко свидетельствует о его огромной важности для цивилизации. Еще несколько десятилетий
назад были известны три основных аллотропных формы углерода: алмаз, графит и карбин. Однако в последнее время были открыты новые
модификации углерода, обладающие уникальными свойствами – фуллерены и углеродные нанотрубки.
Каждый атом углерода в структуре алмаза расположен в центре тетраэдра, вершинами которого служат четыре ближайших атома. Соседние
атомы связаны между собой ковалентными связями (sp3-гибридизация). Такая структура определяет свойства алмаза как самого
твердого вещества, известного на Земле. Графит находит широкое применение в самых разнообразных сферах человеческой деятельности, от
изготовления карандашных грифелей до блоков замедления нейтронов в ядерных реакторах. Атомы углерода в кристаллической структуре графита
связаны между собой прочными ковалентными связями (sp2- гибридизация) и формируют шестиугольные кольца, образующие, в свою
очередь, прочную и стабильную сетку, похожую на пчелиные соты. Сетки располагаются друг над другом слоями. Расстояние между атомами,
расположенными в вершинах правильных шестиугольников, равно 0,142 нм., между слоями – 0,335 нм. Слои слабо связаны между собой.
Такая структура - прочные слои углерода, слабо связанные между собой, определяет специфические свойства графита: низкую твёрдость и
способность легко расслаиваться на мельчайшие чешуйки. В карбине наблюдается линейное расположение атомов, в виде цепочек. Он подразделяется
на две модификации: с кумулированными связями =С=С=С= и полииновыми -С≡С-С≡С- связями. Известны и другие формы углерода, такие
как аморфный углерод, белый углерод (чаоит) и т.д. Но все эти формы являются композитами, то есть смесью малых фрагментов графита и
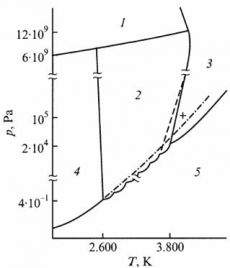
алмаза. Ниже представлена диаграмма состояния углерода, в которой выделяются алмаз (1), карбин (2), жидкость (3), графит (4), пар (5):
Алмаз и графит, известные человечеству с давних времен, нашли широкое практическое применение задолго до расшифровки их структуры,
которая была окончательно установлена только после разработки соответствующих физико-химических методов анализа (рентгенографии,
электронографии и т.п.). В отношении карбина и фуллеренов картина обратная: их структуры установлены, а области применения могут пока
только планироваться на основании возможных технологических свойств.
Материалы на основе графита
Графит, если рассматривать его идеализированную структуру, представляет собой непрерывный ряд слоев, параллельных основной плоскости
и состоящих из гексагонально связанных друг с другом атомов углерода. По взаимному смещению этих слоев в плоскости различают
гексагональную и ромбоэдрическую формы. В гексагональной форме слои чередуются по схеме А-В-А-В-..., а в ромбоэдрической по схеме А-В-С-А-В-С-...
Содержание ромбоэдрической формы может достигать в природных графитах 30 %, в искусственных она практически не встречается. Расстояние между
любыми соседними атомами углерода в плоскости слоя равно 0,142 нм, между соседними слоями 0,335 нм. Каждый атом в слое связан с тремя соседними,
и углы между связями составляют 120°. В связях участвуют три валентных электрона из четырех, оставшиеся электроны образуют общее электронное
облако, аналогичное имеющемуся у металлов. Такое строение приводит к анизотропии физических свойств графита в направлениях параллельном и
перпендикулярном слоям. Графит - вещество темно-серого цвета с металлическим блеском. Это один из самых мягких минералов. Описанная структура
характерна для монокристалла графита. Реальные тела состоят из множества областей упорядоченности углеродных атомов, имеющих конечные размеры,
отличающиеся на несколько порядков для различных образцов углеродистых тел графитовой или графитоподобной структуры. Структура этих областей
может приближаться к идеальной решетке графита или отличаться от нее за счет искажений как внутри слоев, так и за счет неправильностей их
чередования. Такие области упорядоченности называются кристаллитами и имеют собственные геометрические характеристики: La - средний
диаметр, Lc - средняя высота кристаллита и d002 - среднее расстояние между слоями в кристаллите. Эти величины определяются
с помощью рентгенографического анализа. Кроме того, в реальных графитовых телах имеется некоторое количество неупорядоченных атомов (аморфный
углерод), занимающих пространство между кристаллитами или внедренных между слоями. Эти атомы могут находиться в sp, sp2 или
sp3-гибридном состоянии.
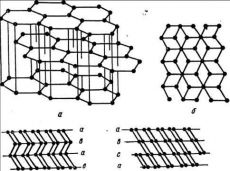
Материал, состоящий главным образом из атомов углерода, может быть получен разными путями. Все они связаны с высокотемпературной обработкой
различных углеродсодержащих веществ как в конденсированной, так и в газовой фазах. Из газовой фазы возможно получение сажи, фуллеренов,
пироуглерода (пирографита), алмазов. Сажа и фуллерены получаются в результате процессов, протекающих в реакционном объеме. Пироуглерод и
алмазы образуются при отложении атомов углерода на твердой подложке. В зависимости от происхождения различают три основных вида графита с
почти идеальной структурой: природный графит; графит, кристаллизующийся в процессе выплавки чугуна (спелевый, или киш-графит, доменный графит);
синтетический графит, образующийся при дегидрогенизации и полимеризации углеродов из конденсированной или газовой фазы.
Среди материалов, построенных из атомов углерода, особое место занимает так называемый активный углерод. Его можно представить как конструкцию,
построенную из слоев атомов углерода, образующих структуру, подобную графиту. Отличие от графита обусловлено различной степенью внутри- и
межслоевой разупорядоченности атомов. Благодаря такой конструкции активный углерод имеет так называемое пористое пространство, объем и размер
пор которого определяются размером первичных кристаллитов, характером их упаковки и взаимной ориентацией. В связи с этим другим часто
встречающимся в литературе названием активного углерода является название "пористый углеродный материал" (ПУМ).
Поры различают по размерам на микропоры (<2 нм), мезопоры (2-50 нм) и макропоры (>50 нм). Благодаря наличию пор ПУМ имеют развитую
поверхность и способны адсорбировать жидкости и газы. Способность ПУМ к адсорбции определяется строением поверхности и природой и концентрацией
поверхностных реакционноспособных групп (обычно кислородсодержащие группы, образующиеся в результате окисления поверхности).
В настоящее время ПУМ представляют собой важнейший класс адсорбентов, катализаторов и носителей, промышленное производство которых
приближается к миллиону тонн. Традиционной схемой получения ПУМ является высокотемпературный пиролиз (карбонизация) твердого углеродсодержащего
сырья (древесина, природные угли, полимерные материалы) с последующей обработкой продукта карбонизации парами воды, двуокисью углерода и
другими веществами, окисляющими углерод (стадия активации).

При своей достаточной простоте и дешевизне, этот способ имеет 2 основных недостатка: углеродные кластеры и кристаллиты образуются в
результате твердофазных плохо контролируемых превращений исходного углеродсодержащего сырья, минеральные примеси, содержащиеся в исходном
сырье, переходят в состав конечного углеродного материала.
Этих недостатков лишен 2 метод получения ПУМ – способ каталитического разложения газообразных углеводородов. Этот способ принципиально
отличается от первого. Так, в традиционном синтезе идет карбонизация твердого образца, сопровождающаяся удалением части углерода, поэтому с
течением синтеза пористость возрастает. Во втором же случае идет рост углеродного каркаса, поэтому с течением времени поры уменьшаются или
даже полностью зарастают.

Из-за более высокой молекулярной "однородности" газообразного углеводородного сырья и гораздо меньшего содержания в нем неуглеродсодержащих
примесей ПУМ, полученные по второй схеме, отличаются гораздо более низким содержанием минеральных примесей, более высокой однородностью,
узким распределением характеристик текстуры. В целом они обладают повышенной механической прочностью и химической стойкостью в агрессивных
средах. Благодаря этим положительным свойствам ПУМ, полученные по каталитическому методу рассматриваются как чрезвычайно перспективные сорбенты
и носители для современных адсорбционно-каталитических технологий.
Ключевым моментом в формировании твердой углеродной фазы является образование плоских полиароматических молекул. Эти молекулы рассматриваются
как первичные структурные элементы большинства ПУМ. В литературе для их обозначения используются разные названия, чаще всего их называют
графенами. Атомы углерода на периферии графенов ненасыщенны, обладают повышенной химической активностью и для компенсации свободной валентности
могут связываться с фрагментами СН2, СН и др. Такие фрагменты могут приводить к образованию углеродных мостиков между торцами соседних графенов,
приводя их к химической "сшивке" под разными углами. В то же время плоская форма графенов способствует их самопроизвольной ориентированной
агрегации в плотноупакованные пачки, которые обычно называются графеновыми кластерами. При этом с точки зрения термодинамики наиболее
выгодным является плоская упаковка графенов.
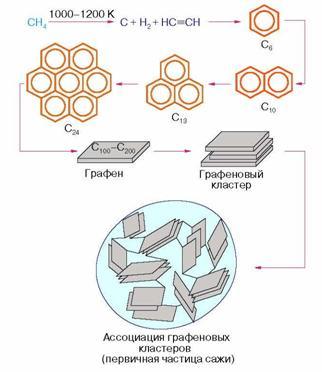
Хаотическое "сращивание" графеновых кластеров в ассоциаты, происходящее в газовой фазе, приводит к образованию сфероидальных частиц
аморфного углерода (различного типа саж). В таких ассоциатах графеновые кластеры связаны друг с другом многочисленными связями, но при очень
высоких температурах (-3000 К) имеют достаточную подвижность, чтобы из разупорядоченной ориентации относительно друг друга (возникшей при их
хаотическом "слипании" и "сшивке" в газовой фазе) перейти в более термодинамически выгодную упорядоченную ориентацию, при которой ассоциат
графеновых кластеров превращается в микрокристаллит графита.
Государственный стандарт требует называть cажу "углерод технический", однако, как правило, этот термин применяется только в технической
литературе и документации. В научной литературе чаще используется термин "сажа". Частица сажи представляет собой набор отдельных кристаллитов,
состоящих обычно из 3-5 параллельных слоев гексагонов. Структура кристаллитов сажи отличается от графитовой тем, что параллельные слои в ней
смещены друг относительно друга не регулярно, как в графите, а хаотически, придавая кристаллитам не упорядоченную трехмерно структуру. Такая
кристаллическая решетка называется двухмерно упорядоченной или турбостратной, в которой слои развернуты вокруг вертикальной оси на некоторый
угол.
Атомы углерода, находящиеся на краях плоскостей кристаллических решеток, имеют свободные валентности. По этим валентностям к ним
присоединяются атомы отдельных плоских решеток углерода (одиночные слои, не входящие в кристаллит) и цепи атомов углерода, не ориентированные
в кристаллическую систему. Эти цепи заполняют промежутки между кристаллитами, цементируя их в одно целое. Кроме того, к свободным валентностям
атомов углерода присоединяются атомы Н, О и S. Форма частиц сажи обычно близка к шарообразной, причем поверхность их может быть как гладкой,
так и шероховатой. Кристаллиты, расположенные в глубине сажевой частицы, ориентированы беспорядочно друг относительно друга, а находящиеся
вблизи поверхности формируют сферическую оболочку.
Сажевые частицы объединяются в сажевые структуры, которые представляют собой более или менее разветвленные цепочки. Различают два вида
структур сажи: первичные, очень прочные, связанные валентными связями, и вторичные, связанные сорбционными силами. Величина частиц сажи, а
также удельная поверхность и степень структурности (разветвленность сажевых цепочек) зависят от условий их образования. Свойства сажи
определяются главным образом этими характеристиками. Сажа является полидисперсным веществом: в образце сажи одного и того же вида имеются
частицы различной величины. От степени дисперсности зависят многие свойства саж, в частности, удельная поверхность и цвет. Чем выше дисперсность
саж, тем она имеет более черный цвет и большую удельную поверхность. Сажа с более высокой структурностью имеет более высокую электропроводность
и меньшую кажущуюся плотность, чем сажа, не имеющая сложных структур.
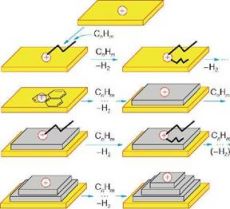 Схема механизма образования слоев углерода при пиролизе углеводородов в присутствии твердого катализатора кислотно-основной природы.
Значком + обозначен электрофильный центр (вакансия электронной пары), который взаимодействует с углеводородами (обозначены зигзагообразными
линиями), дегидрируя и превращая их сначала в циклические олигомеры, а затем в графены, при этом электрофильный центр "переходит" на один
из атомов углерода графена. Повторение стадий приводит к образованию второго, третьего ит.д. слоя графенов. При этом каждый раз электрофильный
центр "перепрыгивает" на атомы углерода последнего слоя графена
Схема механизма образования слоев углерода при пиролизе углеводородов в присутствии твердого катализатора кислотно-основной природы.
Значком + обозначен электрофильный центр (вакансия электронной пары), который взаимодействует с углеводородами (обозначены зигзагообразными
линиями), дегидрируя и превращая их сначала в циклические олигомеры, а затем в графены, при этом электрофильный центр "переходит" на один
из атомов углерода графена. Повторение стадий приводит к образованию второго, третьего ит.д. слоя графенов. При этом каждый раз электрофильный
центр "перепрыгивает" на атомы углерода последнего слоя графена
|
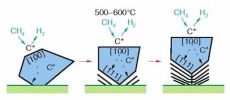 Схема механизма образования слоев углерода при пиролизе углеводородов
в присутствии металлических катализаторов (на примере кристалла Ni). Значком С* обозначен атом углерода, образовавшийся из молекулы метана и
находящийся на поверхности кристалла металла на грани [100] (в плоскости этой грани произвольно взятый атом имеет четыре ближайших соседа).
Значком С* обозначен атом углерода, находящийся в объеме металла; графены образуются на грани [111 ] (в плоскости этой грани произвольно взятый
атом Ni имеет шесть ближайших соседей). Область выделения графенов приблизительно совпадает с размером граней [111]; полное покрытие поверхности
грани [111] и продолжающаяся диффузия атомов углерода из объема приводит к отслоению графена и образованию нового. В целом результатом этого
процесса является образование пачек ориентированно упакованных графенов
Схема механизма образования слоев углерода при пиролизе углеводородов
в присутствии металлических катализаторов (на примере кристалла Ni). Значком С* обозначен атом углерода, образовавшийся из молекулы метана и
находящийся на поверхности кристалла металла на грани [100] (в плоскости этой грани произвольно взятый атом имеет четыре ближайших соседа).
Значком С* обозначен атом углерода, находящийся в объеме металла; графены образуются на грани [111 ] (в плоскости этой грани произвольно взятый
атом Ni имеет шесть ближайших соседей). Область выделения графенов приблизительно совпадает с размером граней [111]; полное покрытие поверхности
грани [111] и продолжающаяся диффузия атомов углерода из объема приводит к отслоению графена и образованию нового. В целом результатом этого
процесса является образование пачек ориентированно упакованных графенов
|
Получение сажи основано на разложении углеводородов под действием высокой температуры. Образование сажи может происходить в пламени горящего
сырья при ограниченном доступе воздуха, а также при термическом разложении сырья в отсутствие воздуха. Углерод при этом выделяется в виде
твердой фазы. Реакция является эндотермической, поэтому в процесс необходимо вносить тепло сжиганием либо части сырья, либо газообразного
или жидкого топлива. Основное количество углеводородов разлагается с образованием сажи в реакционном объеме при температуре выше 1000°С.
Скорость термического разложения углеводородов зависит от температуры процесса. Чем она выше, тем большее количество сажевых частиц будет
сформировано за данный промежуток времени и, соответственно, меньше их диаметр при ограниченном количестве сырья. Следовательно, более
дисперсная сажа будет получаться при более высокой температуре. Рост сажевых частиц может быть предотвращен также за счет снижения
концентрации разлагаемого углеводорода и времени пребывания частиц в реакционной зоне.
Анизотропия различных графитов характеризуется отношением коэффициентов расширения образца в параллельном и перпендикулярном слоям
направлениях. Это отношение меняется для различных графитов от 1 до 30. При атмосферном давлении и высоких температурах графит сублимирует,
не переходя в жидкое состояние, но в области высоких давлений и температур он плавится, что было установлено по скачку электросопротивления
примерно при Т=4000К и р=10МПа. Точка равновесия графит-алмаз-расплав находится в области Т=4000-4200К и р=12,5-13,5ГПа.
Пластическая деформация кристаллитов в ряде случаев сопровождается появлением видимых линий сдвигов и следов скольжения. Деформация
осуществляется в определенных направлениях, а именно в плоскостях и направлениях с наименьшим сопротивлением сдвигу, то есть по плоскостям,
образованным гексагонально связанными атомами углерода, в направлении параллельном этим плоскостям. Особенности кристаллической структуры
графита и малая величина сил связи между его слоями обусловливают скольжение слоев относительно друг друга даже при малых значениях напряжений
сдвига в направлении скольжения. Это позволяет использовать многие углеграфитовые материалы в качестве антифрикционных, работающих без смазки
за счет низких сил сцепления между соприкасающимися поверхностями. С другой стороны, отсутствие прочных межслоевых связей в графите облегчает
отделение его частиц от трущихся деталей, что приводит к увеличению их износа.
В направлении им перпендикулярном графит ведет себя как полупроводник, проводимость которого определяется положительными дырками. Естественно
поэтому, что электропроводность графита в параллельном слоям направлении примерно на два-три порядка превышает проводимость в направлении ему
перпендикулярном. В поликристаллических углеродных материалах общая проводимость определяется двумя составляющими: электропроводностью
кристаллитов, металлической по своему типу, и проводимостью аморфного углерода - полупроводника. Этим обусловлена экстремальная зависимость
электропроводности многих углеграфитовых материалов от температуры: электросопротивление полупроводника с ростом температуры падает, а металла
растет. Поэтому существует минимум температурной зависимости сопротивления, причем его положение смещается в область более низких температур
при совершенствовании кристаллической структуры образца. Таким образом, по положению экстремума можно судить о степени приближения структуры
к идеальной графитовой.
... Продолжение статьи>>
Авторы статьи: А.Дунаев, А.Шапорев
Источник: Нанометр
Страницы: 1 |
2 |
3 |
4 |
5 |
6 |
Перейти к разделу "Статьи"
|



